- 結晶は、原子や分子、イオンが規則正しくあるパターンの配置を繰り返して並んでいる物質。結合する力の違いでいくつかの種類にわけられます。
- アモルファス(非晶質)は、結晶のような規則正しい配置を持たない、あるいは持っていても部分部分であるような物質です。
結晶とは
結晶とは、原子や分子、イオンが規則正しくあるパターンの配置を繰り返して並んでいる物質で、一般的に固体。
規則正しい多面体の形をしたものが多いです。
単結晶
ほとんどの鉱物やすべての金属、多くの無機化合物や有機化合物は結晶。鉱物などは固体全体でひとつの結晶になるものが単結晶。
多結晶
金属材料などは、原子の並びの向きが異なる多数の小さい結晶からできていて、そのような結晶が多結晶いいます。
結晶は原子や分子、イオンがそれぞれ結びつく力の違いによってわけらる
共有結合結晶
ダイヤモンド(炭素)、シリコン(ケイ素)など、各原子同士が共有結合という強い結合で結びついている。そのため、一般的にとても硬くて融点(固体から液体に変化する温度)も高いです。通常、電気はほとんど通しません。
イオン結晶
食塩(塩化ナトリウム)など、プラスの陽イオン(ナトリウムイオンなど)とマイナスの陰イオン(塩化物イオンなど)がイオン結合によって結びついているもの。
イオン結合も強い結合であるため、硬くて融点が高いものが多いです。通常、電気はほとんど通しません。
ただし、電気を通す条件もふたつあります。
- 融点より高い温度を加えて液体にした場合
- 水に溶かして溶液にした場合
金属結晶
鉄、銅、アルミニウムなど、金属原子が金属結合で結びついているもの。金属原子から放出された電子が原子の間を動き回ることで結晶になっています。
そのため金属結晶は、細く伸ばしたり、薄く広げたりすることができる。また、電気や熱も通しやすく、独特の金属光沢をもちます。
分子結晶
氷(水)、ドライアイス(二酸化炭素)など、分子と分子がその間にはたらく相互作用で結びついているもの。共有結合やイオン結合よりも結びつきが弱いため、融点が低かったりやわらかかったりするものが多いです。
アモルファス(非晶質)とは
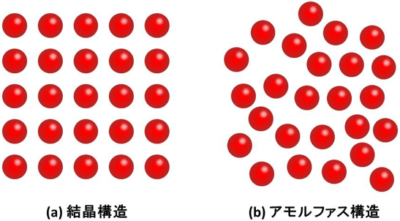
画像引用:国立研究開発法人産業技術総合研究所
アモルファス(非晶質)は、結晶のような規則正しい配置を持たない、あるいは持っていても部分部分であるような物質です。
配置が乱れているという構造は、液体のようであるともいわれます。
アモルファスの例としては、ガラスやゴムがあります。
アモルファスは、溶液や固体が融解して、液体となったものを急に冷やすなどの方法でつくられます。
このような方法でつくったものは、再び加熱したり、長時間放置したりすることで結晶に戻ってしまうことが多い。
同じ物質でも、結晶とアモルファスでは異なる性質となることがあります。
具体的には、
- 電気や熱の伝わりやすさ
- 光や磁力の通りやすさ
- 物体の強度
などに違いがあらわれることがあります。
パワーストーンの売れ筋ランキングもチェック!
なおご参考までに、パワーストーンのAmazon・楽天の売れ筋ランキングは、以下のリンクから確認して下さい。
出典


